编者荐语:
2021年6月,极目生物创始人及CEO胡海迪博士接受了GBI采访,分享了极目生物独特的创新产品管线技术组合,以及清晰的商业化策略与未来发展方向。
* 本文及视频作者:GBI Health
* 如需转载引用文中内容或视频,请联系授权
自2019年成立以来,极目生物一直致力于开发眼科疾病创新疗法,在获得一系列国际眼科前沿创新产品的授权后,已然成为中国的新兴眼科企业之一。最近,该公司与美国专注于眼科神经疗法的公司Olympic Ophthalmics签订独家许可协议,负责后者研发的、用于治疗干眼的外用神经刺激器械 iTEAR®100 在大中华区、韩国和东盟十国的开发和商业化销售。该产品是极目生物的第五个管线产品。
在极目生物与Olympic Ophthalmics达成合作的前几天,GBI 有机会采访到了公司创始人、首席执行官及董事胡海迪博士(Dr. Eddy Wu)。胡海迪博士介绍了公司独特的目标市场策略,即一方面聚焦前沿创新技术,针对解决未满足的临床需求;另一方面聚焦以消费者为导向的产品技术,通过多样化的营销渠道覆盖广大消费者群体。
GBI独家访谈 · 本期嘉宾
胡海迪博士 (Dr. Eddy Wu)
极目生物创始人、首席执行官及董事
胡海迪博士是极目生物的创始人、首席执行官及董事。在创立极目生物之前,他曾担任拓臻生物中国区负责人,负责指导和管理研发活动及业务运营的各个方面。在此之前,他是艾尔建中国的执行医学总监,负责艾尔建在中国的整体临床研发、医学事务和产品管线战略。
胡博士的职业生涯始于诺华,在诺华公司任职期间,他在巴塞尔、香港和台湾担任过各种职务,获得了第一手的全球经验。在诺华公司总部,他曾担任AMAC(亚太、中东和非洲国家)、中国和日本的区域医学负责人和卫生经济学与成果研究(HEOR)负责人。
胡博士毕业于香港科技大学,获得生物化学学士及博士学位。
GBI Health
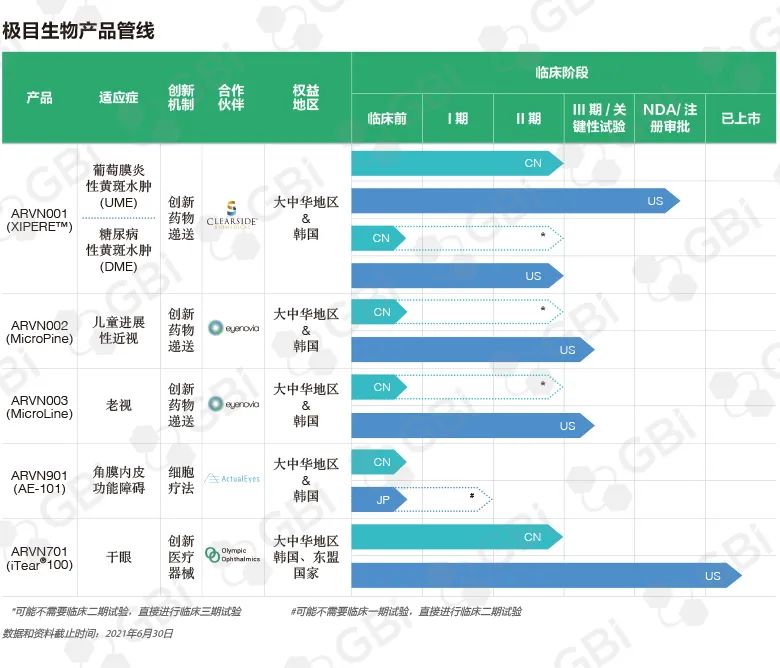
极目生物产品管线
Pipeline of Arctic Vision
GBI独家访谈 · 胡海迪博士
Q
GBI:贵公司最近与日本ActualEyes公司签订的产品引进许可协议针对的是一种真正创新的再生医学/细胞疗法,是一项非常有趣的技术,相比抗 VEGF 药物显然具有领先性。请您介绍一下这次合作及合作的产品。
A
胡博士:首先,角膜内皮功能障碍等角膜疾病在中国是一个很大的问题。数以百万的患者需要进行角膜移植,但由于供体短缺,加上移植手术复杂、对技术要求较高,能够进行操作的外科医生数量不足,这些患者无法接受到及时的治疗。虽然国内已经开发了供体角膜的替代品,例如动物角膜或合成角膜,但这些产品存在移植排斥等问题。
我们从ActualEyes公司引进的是一种细胞治疗技术,从供体角膜中获取细胞,培养和增殖后植入另一个患者(供体和患者可以不同),以这种方式,我们可以用有限的角膜内皮细胞帮助更多的患者。治疗操作过程也比移植更简单,因为对于患者来说,整个操作过程实质上就是一次注射,然后只需再俯卧约3小时,在角膜内皮上形成细胞层。操作过程对医生的技术水平要求较低,即使是普通的眼科医生也可以进行操作。
Q
GBI:现在我们来看看其它的管线产品,分别与美国生物技术公司 Clearside Biomedical 和 Eyenovia 达成的两项合作。
A
胡博士:这三款产品的共同点是都代表了前沿创新技术。我们的第一个产品是 ARVN001(曲安奈德脉络膜上腔注射混悬液),从Clearside Biomedical引进,有望成为我国第一款脉络膜上腔(SCS)注射给药疗法。在美国,它的商品名是XIPERE™。Clearside Biomedical该产品在美国和加拿大的合作方为博士康(Bausch Health)。我们目前正在开发这款产品用于治疗葡萄膜炎性黄斑水肿(UME)和糖尿病黄斑水肿(DME)。由于国内还没有产品获批用于一线治疗葡萄膜炎性黄斑水肿,ARVN001有潜力成为国内葡萄膜炎性黄斑水肿的一线治疗方法。
ARVN001用于葡萄膜炎性黄斑水肿的III期临床试验显示,在进行两次注射后,47%患者的视力取得了至少 15 个字母的改善。(参考:NCT02595398;https://clinicaltrials.gov/ct2/show/NCT02595398?term=PEACHTREE&draw=2&rank=1)。以我在眼科领域的经验来讲,这个疗效数据是非常惊艳的。脉络膜上腔注射技术是提高疗效的主要原因。脉络膜上腔是界于巩膜与脉络膜之间的潜在腔隙,向这个空间注射药物,可以使药物很好地存留在非常靠近视网膜的区域。更重要的是,这种技术可以尽量减少对眼睛其他部位的暴露,降低眼压升高和白内障的风险。药物注射进入后,可以在脉络膜上腔中停留好几个月,不需要依靠不可生物降解或可生物降解的外来成分来维持其疗效的持久性。最终达到的是一石三鸟的效果,即在不使用不可生物降解材料的情况下提供更好的疗效、更高的安全性和更长的持久性。
葡萄膜炎性黄斑水肿是ARVN001临床开发的第一个适应症,同时我们还在开发用于治疗糖尿病黄斑水肿。已经有数据表明该产品为糖尿病黄斑水肿患者带来的临床获益,国内临床开发也已在开展中。
Q
GBI:通过第二笔与 Eyenovia 的交易,极目生物获得了一种非常有趣且可能是世界领先的药物递送平台Optejet®。请给我们讲一讲。
A
胡博士:ARVN002和ARVN003 使用的是微剂量给药技术,我们称之为微矩阵药膜(Micro Array Print, MAP™)。在我看来,这是一个真正的全球范围创新药物递送技术平台。过去使用眼药水,无论我们多么熟练,总会有眼药水从眼睛中溢出,增加了药物系统暴露的风险。主要是因为眼表只能容纳大约8μL的液体,而滴眼液的给药量一般为30μL至40μL。因此,长期以来,眼科医生和技术人员一直在寻找一种能将少量药物递送到眼睛表面的解决方案。
这种由Eyenovia开发的微剂量给药平台Optejet®是一个完美的解决方案。它所使用的技术被称为MAP™,在每次给药时,都会将雾化的药物给至眼表,形成一层完美排列的微小液滴,总体积仅约8 μL,从而减少了药物系统暴露的风险。此外,这是一款易于使用的智能设备,即使是 3 岁的孩子也可以自己使用。它还可以连接到智能手机上,在需要使用时向用户发送提醒。我自己也是一个父亲,如果有一种方法可以保证我的孩子按时接受治疗,并且可以减少副作用,对我来说这将是控制近视的完美解决方案。
我们还将这个技术开发用在了老花眼情境性治疗产品ARVN003。老花眼患者可以随时使用该产品,使用一次可在3~4个小时内不用戴眼镜。你可以看书、与朋友打麻将或上台进行一段演讲——都无需佩戴眼镜。这个产品不需要每天使用,可以放在口袋里,易于携带,比隐形眼镜还方便,不用戴上再取下。
Q
GBI:通过达成战略合作,你们获得了三种处于临床开发后期的产品。我听说Clearside最近向 FDA重新提交了 XIPERE™的上市申请,而且 Eyenovia的临床开发也处于后期阶段。请谈一谈这些对你们公司在国内的发展将产生怎样的影响?
A
胡博士:是的,ARVN001、ARVN002和ARVN003 这三个产品都是处于非常后期的发展阶段。Eyenovia的 MicroPine(用于儿童近视治疗的微量阿托品眼用溶液)和MicroLine(用于老花眼治疗的微量毛果芸香碱眼用溶液),也就是ARVN002和ARVN003,均处于临床III期研究阶段,Eyenovia几天前刚刚宣布了MicroLine用于老花眼适应症的 III 期试验阳性顶线结果。此外,ARVN001也已经在美国提交了上市申请。
我们已经启动和国家药监局的沟通程序。显然,我们希望尽可能地加快产品开发进程。与此同时,还有其他上市途径可以探索。例如省级特殊通道审批,以及港澳台等其他市场,如果公司计划在国内进行进一步临床研究,我们可以尝试先在港澳台市场启动。
Q
GBI:在商业化方面,特别是你们公司一些产品将面向广泛的消费市场,面对激烈的市场竞争,极目生物有什么计划?
A
胡博士:从第一天起,我们就希望自主进行产品商业化,这一点从未改变。正如我之前提到的,我们公司将有两个主要的增长引擎。一种是“黑科技”(突破性创新技术),专注于临床需求未得到满足的特定领域。ARVN901和ARVN001就是很好的例子,这种类型的产品不需要大量销售和管理费用投入。但是需要针对这些病症的特定医师或眼科医生群体进行良好的医学教育和操作培训。
另一个增长引擎将是消费者导向的技术,包括治疗近视、老花眼和干眼产品。对于这种产品,我们将利用新兴的电子商务平台,借助KOL的影响力来教育公众。同样,这也不是典型的销售人员驱动的市场模型。我们可以利用互联网来减少销售及管理费用,同时产生良性收入。
未来,极目生物的发展道路不会是成为一家拥有大量员工的生物技术公司,而是建立一个高度细分、专注和高效创收的商业模式。
Q
GBI:很期待这一天的到来。我们已经对极目生物通过对外合作迅速地取得成功有了一些了解,我想知道你们公司是否有自主研发计划?
A
胡博士:授权引进从来都不是公司的“目标”;这只是我们双管齐下的增长战略的一个方面。公司成立初期,国际上有很多先进的技术还没有进入中国。出于这个原因,我们选择引进产品作为建立公司基础的第一步,但我们不会将其作为未来发展的唯一方向。我们在美国有科学家团队,在中国也在建立一个科研团队。我们很快将公布公司自主研发战略,我现在可以透露的是,公司的自主研发将与我们前面提到的双引擎发展战略保持一致,也就是说,开发在技术方面处于领先地位或具有潜力的产品,或者以消费者为导向的产品。
Q
GBI:非常感谢您的时间,我们对极目生物未来的发展充满期待。
*本文仅截取部分专访内容。GBI用户可登录 GBI SOURCE药品数据库 查看本次专访全部内容。





